Hydrochloride – Khí HCl
Mục lục
Hydrochloride – HCl là một loại khí không màu, không cháy. Nhưng khí HCL độc hại và ăn mòn. Nó thường được tìm thấy dưới dạng dung dịch trong nước gọi là axit clohidric, có tính axit cao. Nó làm giảm pH của nước nó được giải phóng ra và nó cũng ăn mòn.
Dung dịch nước tập trung điển hình nằm trong khoảng 30% HCl theo trọng lượng. Nhưng có nồng độ cao hơn và thấp hơn. Chất này cũng tồn tại trong tự nhiên như một thành phần chính của axit dạ dày. Duy trì độ pH 1-2 ở dạ dày của người.
Những ứng dụng của Hydrochloride – HCl
Hydrochloride là một hóa chất vô cơ với nhiều loại ứng dụng. Chủ yếu là của ngành công nghiệp.
Nó được sử dụng chủ yếu trong ngành công nghiệp như là một chất điều chỉnh pH trong nước và xử lý nước thải.
Sản xuất thực phẩm, trong sản xuất các hóa chất hữu cơ và vô cơ khác.
Nó cũng được sử dụng để tái tạo nhựa trao đổi ion và để ngâm thép (loại bỏ các chất gỉ và các tạp chất từ thép trước khi chế biến hoặc tạo hình).
Chất này được sử dụng làm chất làm sạch để loại bỏ vôi và xử lý nước.
Sử dụng phổ biến nhất là một phần của các sản phẩm làm sạch để loại bỏ quy mô vôi .
Axit Hydrochloric đã được Cơ quan An toàn Thực phẩm Châu Âu (EFSA) đánh giá là an toàn để sử dụng trong sản xuất thực phẩm, mang số E507.
Tính chất của Hydrochloride – HCl
Hydrochloride có thể được tìm thấy dưới dạng khí. Hoặc, thông thường hơn, như là một dung dịch axit clohidride trong nước.
Dạng khí HCL
Hydrochloride là một loại khí không màu tạo thành sương mù trắng khi tiếp xúc với không khí ẩm.
Nó là một axit mạnh. Và nó ăn mòn nhiều kim loại trong sự hiện diện của độ ẩm (nước).
Khí hydrogen clorid khô hoàn toàn không làm ăn mòn các vật liệu thông thường như thép hoặc nhôm. Do đó nó có thể được lưu trữ và vận chuyển như một khí nén trong bình thép.
Dạng dung dịch acid
Khí này cực kỳ hòa tan trong nước (lên đến 700 lít mỗi lít nước ở điều kiện môi trường). Đưa ra dung dịch nước gọi là acid clohiđric.
Nó cũng dễ tan trong dung môi hữu cơ cực đại như methanol, ethanol hoặc axit axetic.
Axit Hydrochloric là chất lỏng ăn mòn, không cháy. Nồng độ điển hình nằm trong khoảng 30% HCl tính theo trọng lượng (còn được gọi là axit clohidro cô đặc).
Nếu axit clohydric được đun sôi, nó sẽ giải phóng khí HCl và tạo ra một azeotrope. Azeotrope sôi ở 110 ° C ở 1013 mbar và chứa 20,2% HCl.
Khả năng ăn mòn chống lại các kim loại thông thường, đá vôi vv phụ thuộc mạnh vào nồng độ của axit clohidride.
Các sản phẩm tiêu dùng thường chỉ chứa một lượng nhỏ HCl (1-2%). Thường được pha loãng hơn để sử dụng trong các hộ gia đình.
Một số chỉ tiêu của khí HCl
Dạng Khí
Thể loại : Khí HCl
Màu: Không màu
Mùi: Mùi chua mốc
Mật độ ở 20°C: 1,64 g / l (khí nặng hơn không khí)
Nhiệt độ nóng chảy: -112 ° C
Trọng lượng phân tử: 36,5 g / mol
Dạng dung dịch Acid với HCl 30%
Thể loại : chất lỏng
Màu: Không màu
Mùi: Mùi chua
Mật độ ở 20°C: 1.149
Nhiệt độ nóng chảy: -50 ° C
Ảnh hưởng đến sức khoẻ con người
Chất này, cả dạng khí và dung dịch nước, là một axit mạnh. Do đó có khả năng ăn mòn mạnh đối với mô người.
Tiếp xúc với chất này sẽ gây bỏng mạnh vào mắt và da không được bảo vệ. Hít phải khí và sương mù (khói) có thể gây kích ứng. Và trong những trường hợp nghiêm trọng có thể dẫn đến phù phổi và tử vong.
Axit hydrochloric tồn tại tự nhiên như là một thành phần chính của axit dạ dày. Duy trì độ pH 1-2 trong dạ dày (dạ dày đã phát triển duy nhất để đối phó với độ chua cao).
Các ứng dụng được xác định đối với chất này đã được đánh giá là an toàn theo một số chương trình quy định khi nó được sử dụng phù hợp và với các biện pháp an toàn có liên quan.
Ảnh hưởng đến môi trường
Axit Hydrochloric làm giảm pH của bất kỳ loại nước nào mà nó được giải phóng vào.
Một lượng nhỏ được pha loãng và vô hiệu hóa bằng phản ứng với các chất cơ bản có trong nước và đất tự nhiên.
Nếu một lượng lớn được giải phóng hoặc nếu có các axit khác, pH có thể được hạ xuống cho đến mức nó có hại cho động vật và thực vật thủy sinh (ở pH 3 đến 5). Vì đây là hiệu quả pH chung và không phải do chất cụ thể, nên hydrogen clorua không được phân loại là độc đối với môi trường nước. Ngoài ra, chất này không tích lũy sinh học, được loại bỏ nhanh chóng (vô hiệu hóa nước và các ion clorua, cả hai đều vô hại) và sẽ không tồn tại trong môi trường.
Trong công nghiệp và đời sống
Việc sử dụng các chất khác nhau đã được đánh giá là an toàn theo một số chương trình quy định. Với điều kiện phải có các biện pháp kiểm soát cần thiết. Người tiêu dùng có thể tiếp xúc với chất này thông qua việc sử dụng nó như một thành phần của một số chất tẩy rửa gia đình.
Việc sử dụng này đã được đánh giá là an toàn. Miễn là sản phẩm được sử dụng theo chỉ dẫn trên nhãn.
Chất này đã được đánh giá là an toàn cho việc sử dụng chuyên nghiệp và công nghiệp.
Môi trường
Sự thải chlorua hydro vào môi trường thường không xảy ra. Vì khí chỉ được sử dụng trong công nghiệp trong các hệ thống khép kín trong điều kiện có kiểm soát.
Nước thải công nghiệp có chứa axit clohiđric được vô hiệu hóa bằng cách thêm một chất cơ bản để đưa ra một dung dịch trung tính và có thể được xử lý an toàn.
Sự phóng thích quy mô nhỏ vào cống rãnh từ các sản phẩm tẩy rửa gia đình không gây nguy hiểm cho môi trường. Do sự pha loãng axit và trung hoà lớn bởi khả năng đệm của hệ thống cống hoặc nước tự nhiên.
Nhãn cảnh báo
Cho khí HCl

Khí nén. Chứa khí dưới áp suất; Có thể bùng nổ nếu đun nóng

Độc tính cấp tính 3: Độc nếu hít phải
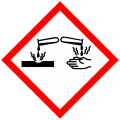
Ăn mòn da 1A: Nguyên nhân bỏng da nghiêm trọng và tổn thương mắt
Xin lưu ý rằng nhãn bao bì có thể khác với phân loại ở trên.
Phần kết luận
Hydrochloride là một chất được hiểu rõ là rất hữu ích cho nhiều ứng dụng thực tiễn. Từ ngành công nghiệp đến các sản phẩm tiêu dùng. Việc sử dụng chất độc hại này đã được chứng minh là an toàn khi trong quá trình sử dụng. Miễn là tuân thủ đúng các hướng dẫn được cung cấp kèm theo.
Nơi cung cấp Khí HCl – Hydrochloride
Vietxuangas chuyên cung cấp các sản phẩm khí Hydrochloride, khí đặc biệt, khí công nghiệp như: Khí propane C3H8, Khí heli, Khí Metan, Khí SF6.
Quý khách có nhu cầu vui lòng liên hệ:
Tư vấn kỹ thuật và bán hàng
Điện thoại/zalo 0902 336 426
Email sales@kattashop.com
Hân hạnh được phục vụ!
Sưu tầm từ wikipedia và một số nguồn nước ngoài